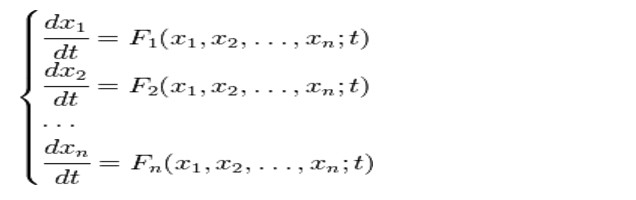رد فعل زانتوبروتين إلى البروتين: علامات وصيغة المعادلة
إنشاء التركيب النوعي للكثيرينالمنتجات الغذائية، ويستخدم رد فعل زانثوبروتين للبروتين. سوف وجود الأحماض الأمينية العطرية في المجمع تعطي تغيير لون إيجابي في العينة قيد الدراسة.
ما هو البروتين
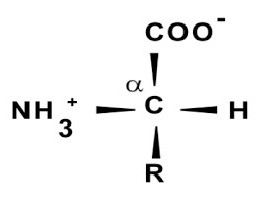
ويسمى أيضا بروتين، وهومواد بناء لكائن حي. البروتينات تدعم حجم العضلات، واستعادة هياكل الأنسجة الصدمة والمميتة من مختلف الأجهزة، سواء كان الشعر أو الجلد أو الأربطة. مع مشاركتهم، يتم إنتاج خلايا الدم الحمراء، وينظم عمل طبيعي من العديد من الهرمونات وخلايا الجهاز المناعي.
هذا هو جزيء معقد، وهو ببتيد مع كتلة أكبر من 6 * 103 دالتون. ويتكون هيكل البروتين من بقايا الأحماض الأمينية بكميات كبيرة متصلة من قبل رابطة الببتيد.
بنية البروتينات
سمة مميزة لهذه المواد في المقارنةمع الببتيدات منخفضة الجزيئية هو هيكلها المكاني ثلاثي الأبعاد المتقدمة، بدعم من التأثيرات مع درجات مختلفة من الجذب. البروتينات لديها بنية من أربعة مستويات. لكل منها، وخصائصها هي الكامنة.
يتم أخذ أساس التنظيم الأساسي لجزيئاتهموهو تسلسل الأحماض الأمينية التي يتم التعرف على هيكلها من خلال رد فعل زانتوبروتين إلى البروتين. مثل هذا الهيكل هو تكرار دوري الببتيد السندات -HN- تش-CO-، والجزء الانتقائي هو الجذور سلسلة جانبية في الأحماض أمينوكربوكسيلية. وهي تحدد خصائص المادة ككل في المستقبل.
ويعتبر هيكل البروتين الأساسي كافياقوي، وهذا يرجع إلى وجود تفاعلات التساهمية قوية في السندات الببتيد. ويحدث تشكيل المستويات اللاحقة تبعا للعلامات التي وضعت في المرحلة الأولية.
يمكن تكوين البنية الثانوية بسبب التواء تسلسل الحمض الأميني إلى حلزون يتم فيه إنشاء روابط هيدروجينية بين المنعطفات.
المستوى الثالث من تنظيم الجزيء يتشكلعندما يتم وضع جزء من اللولب على شظايا أخرى ، مع كل أنواع الروابط التي تنشأ بينهما ، مع مركبات الهيدروجين ، ثنائي التكافؤ ، التساهمية أو الأيونية. ونتيجة لذلك ، يتم الحصول على الجمعيات في شكل كريات.

إن الترتيب المكاني للهياكل الثلاثية مع تشكيل روابط كيميائية بينهما يؤدي إلى تكوين نوع محدود من الجزيء أو مستوى رباعي.
الأحماض الأمينية
هم الذين يحددون الخصائص الكيميائيةالبروتينات. هناك حوالي 20 من الأحماض الأمينية الرئيسية التي تشكل polypeptides في تسلسلات مختلفة. وهذا يشمل أيضًا أحماض كربونية aminocarboxylic نادرة في شكل hydroxyproline و hydroxylizine ، وهي مشتقة من الببتيدات الأساسية.
كعلامة على رد فعل بروتينات كسينتوبروتينالتعرف على البروتينات ، وجود الأحماض الأمينية الفردية يعطي تغييرا في لون الكواشف ، مما يشير إلى وجود هياكل محددة في تكوينها.
كما تبين ، كلهم أحماض كربوكسيلية ، حيث يتم استبدال ذرة الهيدروجين بمجموعة أمينية.
مثال على بنية الجزيء هو الصيغة البنائية للجليسين (HNH-HCH-COOH) كأبسط حمض أميني.

في هذه الحالة ، واحد من CH2- يمكن استبدال الكربون بجذور أطول بما في ذلك مجموعة البنزين ، والأحماض الأمينية ، والسلفو ، ومجموعات الكربوكسي.
ماذا يعني رد فعل البروتين xantoprotein؟
لإجراء تحليل نوعي للبروتينات ، يتم استخدام أساليب مختلفة. وتشمل هذه ردود الفعل:
- biuretovuyu مع ظهور تلطيخ البنفسجي.
- نينهيدرين لتشكيل حل بنفسجي أزرق.
- الفورمالديهايد مع إنشاء تلوين أحمر.
- فولي مع هطول الأمطار من اللون الرمادي والأسود.
في تنفيذ كل طريقة ، يظهر وجود البروتينات ووجود مجموعة وظيفية معينة في جزيئهم.
هناك رد فعل البروتين xantoprotein على البروتين. ويسمى أيضا انهيار مولدر. وهو يشير إلى تفاعلات اللون مع البروتينات التي توجد فيها الأحماض الأمينية العطرية وغير المتجانسة.
ومن مميزات هذه العينة عملية النترتة بحمض بقايا حمض أميني دوري من النيتروجين ، على وجه الخصوص ، إضافة مجموعة نيترو إلى حلقة بنزين.
نتيجة هذه العملية هي تكوين مركب نيترو يترسب. هذه هي العلامة الرئيسية لتفاعل xantoprotein.
ما هي الأحماض الأمينية
لا يمكن الكشف عن جميع أحماض aminocarboxylic معباستخدام مثل هذه العينة. العلامة الرئيسية لبروتينات تفاعل بروتينات xantoprotein هو وجود حلقة بنزين أو غير متجانسة في جزيء الحمض الأميني.
من الأحماض الأمينية ل carboxylic البروتين ، يتم تمييز اثنين من الأحماض العطرية ، التي يوجد فيها مجموعة الفنيل (في الفنيل الأنين) وجذور الهيدروكسفينيل (في التيروزين).
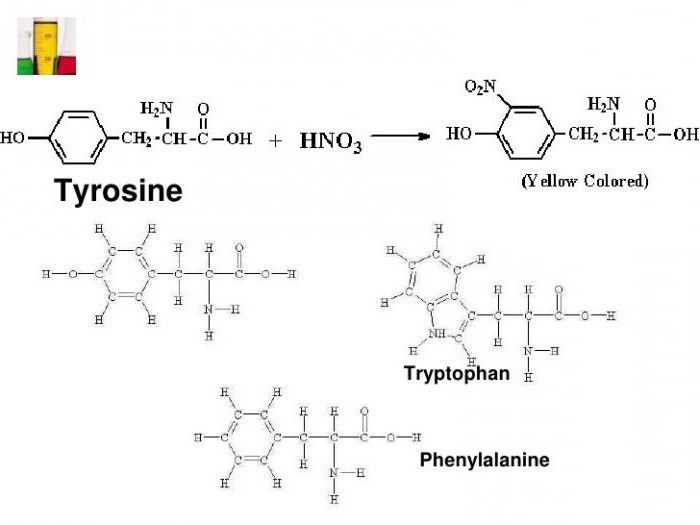
باستخدام رد فعل البروتين xantoprotein ،الأحماض الأمينية غير المتجانسة الحلزونية تريبتوفان وجود نواة إينول العطرية. وجود المركبات المذكورة أعلاه في البروتين يعطي تغييراً مميزاً في لون وسط الاختبار.
ما الكواشف المستخدمة
لتنفيذ رد فعل بروتينات xantoprotein ، سيكون من الضروري تحضير محلول 1٪ من البروتينات النباتية أو البيض.
عادة ما تستخدم بيضة الدجاج ، والتي مكسورةلمزيد من فصل البروتين من الصفار. لإنتاج محلول ، يتم تخفيف 1 ٪ من البروتين في كمية من الماء تنقيع عشرة أضعاف. بعد إذابة البروتين ، يجب تصفية السائل الناتج من خلال عدة طبقات من الشاش. يجب تخزين هذا الحل في مكان بارد.
من الممكن إجراء تفاعل مع بروتين نباتي. لإعداد المحلول ، يتم استخدام دقيق القمح بكمية 0.04 كجم. أضف 0.16 لتر من الماء النقي. يتم خلط المكونات في قارورة ، والتي يتم وضعها لمدة 24 ساعة في مكان بارد مع درجة حرارة حوالي + 1 درجة مئوية. بعد يوم ، يتم اهتزاز المحلول ، ثم يتم تصفيته أولاً باستخدام الصوف القطني ، ثم باستخدام مرشح طي الورق. يتم الاحتفاظ السائل الناتج في مكان بارد. في مثل هذا الحل ، هناك بشكل رئيسي جزء الزلال.
لتنفيذ رد فعل البروتين xantoprotein فيكاشف رئيسي ، يتم استخدام حمض النيتريك المركز. الكواشف الإضافية هي عبارة عن محلول 10٪ من هيدروكسيد الصوديوم أو الأمونيا ، محلول الجيلاتين والفينول غير المركّز.
طريقة إجراء
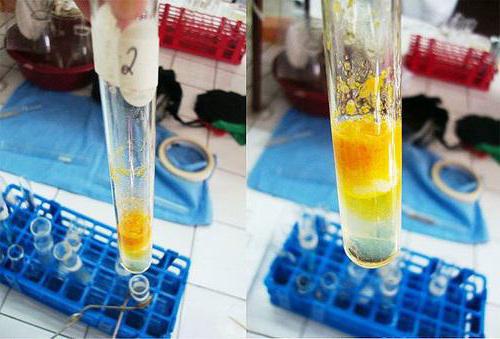
يضاف محلول بياض البيض بنسبة 1٪ إلى أنبوب اختبار نظيفأو الطحين بكمية 2 مل. تتم إضافة حوالي 9 قطرات من حمض النيتريك المركز إليها ، حتى يتوقف الترويب. يتم تسخين الخليط الناتج ، ونتيجة لذلك ، يتحول الراسب إلى اللون الأصفر ويختفي تدريجيا ، ويتحول لونه إلى محلول.
عندما يبرد السائل ، إلى أنبوب اختبار بواسطة stenochkeإضافة حوالي 9 قطرات من هيدروكسيد الصوديوم تتركز ، وهو فائض لهذه العملية. يصبح تفاعل الوسط قلويًا. تصبح محتويات أنبوب الاختبار برتقالية اللون.
ميزات هذا الحدث
منذ يسمى زانثوبروتين النوعيةرد فعل على البروتينات تحت تأثير حمض النيتريك ، وتجرى العينة تحت غطاء محرك السيارة المغلقة. مراقبة جميع احتياطات السلامة عند التعامل مع المواد الكاوية المركزة.
أثناء عملية التسخين ، يمكن إخراج المحتويات من الأنبوب ، والتي يجب أخذها بعين الاعتبار عند إرفاقها بالحامل واختيار المنحدر.
يجب أن يتم توظيف حامض النيتريك المركز والصوديوم الكاوي فقط مع ماصة الزجاج والكمثرى المطاطي ، ويحظر التقاط مع الفم.
تفاعل مقارن مع الفينول
من أجل توضيح العملية وتأكيد وجود مجموعة فينيل ، يتم تنفيذ عينة مماثلة مع hydroxybenzene.
في أنبوب اختبار ، إضافة 2 مل من الفينول المخفف ، ثمتدريجيا ، من خلال stenochke ، إضافة 2 مل من حامض النيتريك تتركز. الحل يخضع للتدفئة ، حيث يصبح أصفر. هذا التفاعل هو نوعي لوجود حلقة بنزين.
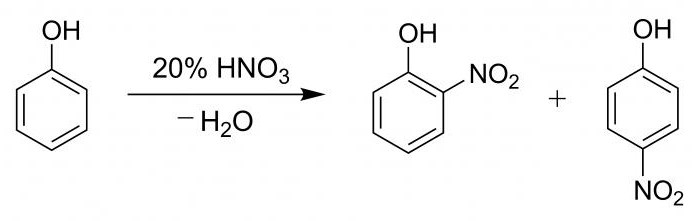
ويرافق عملية نيترة هيدروكسي بنزين مع حمض النيتريك عن طريق تكوين خليط من البرانتروفينول و orthotrophenol بنسبة مئوية تتراوح من 15 إلى 35.
اختبار مقارن مع الجيلاتين
لإثبات أن رد فعل البروتين xantoprotein للبروتين يكشف عن الأحماض الأمينية فقط مع بنية عطرية ، يتم استخدام البروتينات التي لا تحتوي على مجموعة الفينولية.
يضاف محلول جيلاتين 1٪ إلى أنبوب اختبار نظيففي كمية 2 مل. يضاف إليها 9 قطرات من حمض النيتريك المركز. تم تسخين الخليط الناتج. الحل ليس أصفر اللون ، مما يثبت عدم وجود الأحماض الأمينية مع بنية عطرية. في بعض الأحيان يكون هناك إصفرار طفيف للوسط ، بسبب وجود شوائب البروتين.
المعادلات الكيميائية
يحدث رد فعل البروتين xantoprotein على البروتينات على مرحلتين. تصف الصيغة للمرحلة الأولى عملية نيترة جزيء الحمض الأميني مع حمض نيتروجيني مركّز.
مثال على ذلك هو إضافة مجموعة نيترو إلى التيروزين مع تكوين نيتروتيروزين ودينيتوتروزين. في الحالة الأولى ، يتم إرفاق NO NO إلى حلقة البنزين2-radical ، وفي المركب الثاني بالفعل يتم استبدال ذرتين hydrogen بـ NO2. يتم تمثيل الصيغة الكيميائية لتفاعل xantoprotein بتفاعل التيروزين مع حمض النيتريك مع تكوين جزيء النتروتيروزين.
عملية النترتة مصحوبة بعملية انتقالتلوين عديم اللون باللون الأصفر. عند تنفيذ تفاعل مماثل مع البروتينات التي تحتوي على بقايا الأحماض الأمينية من التريبتوفان أو الفنيل الأنين ، يتغير لون المحلول أيضًا.
في المرحلة الثانية ، هناك تفاعلمنتجات نتروجين لجزيء التيروزين ، ولا سيما النيتروزروزين ، مع الأمونيوم أو هيدروكسيد الصوديوم. وتكون النتيجة ملحًا من الصوديوم أو الأمونيوم ، يكون فيه اللون أصفر-برتقالي. ويرتبط هذا التفاعل مع احتمال وجود جزيء من انتقال النيتروزيروزين إلى شكل كينوي. في وقت لاحق ، يتكون ملح حامض النترونيك منه ، والذي يحتوي على نظام quinone من الروابط المزدوجة المقترنة.

وبالتالي ، فإن رد فعل البروتين xantoprotein إلى البروتينات ينتهي. يتم عرض معادلة المرحلة الثانية أعلاه.
النتائج
خلال تحليل السوائل الواردة في ثلاثةأنابيب الاختبار ، الفينول المخفف هو الحل التخفيف. تعطي المواد التي تحتوي على حلقة بنزين تفاعلًا نوعيًا مع حمض النيتريك. نتيجة لذلك ، يتغير لون الحل.
كما هو معروف ، يتضمن الجيلاتين الكولاجين فيشكل هيدروليزيد. هذا البروتين لا يحتوي على أحماض aminocarboxylic بنية عطرية. عند التفاعل مع حمض ، لا يتغير لون الوسط.
في أنبوب الاختبار الثالث ، وهو إيجابيرد فعل البروتين xantoprotein إلى البروتينات. يمكن التوصل إلى الاستنتاج التالي: جميع البروتينات ذات البنية العطرية ، سواء كانت مجموعة فينيل أو حلقة إندول ، تعطي تغيير لون الحل. هذا يرجع إلى تشكيل مركبات النيترو ذات اللون الأصفر.
إجراء تفاعل لون يثبت وجودبنية كيميائية متنوعة في الأحماض الأمينية والبروتينات. يوضح مثال الجيلاتين أنه يحتوي على أحماض aminocarboxylic التي لا تحتوي على مجموعة phenyl أو بنية دورية.
باستخدام تفاعل xantoprotein ، من الممكن شرح اصفرار الجلد عند تطبيق حمض النيتريك القوي عليه. سيتم الحصول على نفس اللون بواسطة رغوة الحليب عند إجراء تحليل مماثل معها.
في الممارسة المخبرية الطبية ، لا تستخدم هذه العينة اللون للكشف عن البروتين في البول. هذا يرجع إلى اللون الأصفر للبول نفسه.
أصبح رد فعل البروتين xantoprotein يستخدم بشكل متزايد لقياس مثل هذه الأحماض الأمينية كما التربتوفان والتيروزين ، كجزء من البروتينات المختلفة.
</ p>