السندات المعدنية: آلية التعليم. السندات الكيميائية المعدنية: أمثلة
جميع الكيميائية المعروفة حتى الآنتنقسم العناصر في جدول مندلييف تقليديا إلى مجموعتين كبيرتين: المعادن واللمعادن. من أجل أن تصبح ليست مجرد عناصر، ولكن المركبات والمواد الكيميائية، فإنها يمكن أن تتفاعل مع بعضها البعض، يجب أن تكون موجودة في شكل مواد بسيطة ومعقدة.
ولهذا الغرض تحاول بعض الإلكتروناتقبول، وغيرها - إعطاء. وباستبدال بعضها البعض بهذه الطريقة، تشكل العناصر جزيئات كيميائية مختلفة. ولكن ما الذي يسمح لهم بالبقاء معا؟ لماذا هناك مواد من هذه القوة، والتي لا يمكن تدميرها حتى من قبل أخطر الأدوات؟ وعلى العكس من ذلك، يتم تدمير الآخرين بأدنى تأثير. ويوضح كل هذا من خلال تشكيل أنواع مختلفة من الروابط الكيميائية بين الذرات في الجزيئات، وتشكيل شعرية الكريستال من بنية معينة.

أنواع الروابط الكيميائية في المركبات
في المجموع، هناك 4 أنواع رئيسية من الروابط الكيميائية.
- التساهمية غير القطبية. وهي تتشكل بين اثنين من اللافلزات متطابقة بسبب التنشئة الاجتماعية للإلكترونات، وتشكيل أزواج إلكترونية مشتركة. وتشارك جسيمات التكافؤ غير المتكافئة في تكوينها. أمثلة: الهالوجينات والأكسجين والهيدروجين والنيتروجين والكبريت والفوسفور.
- التساهمية القطبية. وهي تتشكل بين اثنين من غير المعادن المختلفة، أو بين المعدن الذي هو ضعيف جدا في الخصائص وغير المعدنية ضعيفة في إليكترونيغاتيفيتي. في جوهرها هي أيضا أزواج الإلكترون الشائعة والجر بهم إلى الذات من قبل تلك الذرة التي تقارب الإلكترون هو أعلى. أمثلة: نه3, سيك، P2O5 وغيرها.
- رابطة الهيدروجين. الأكثر غير مستقرة وضعيفة، بين ذرة كهربية قوية من جزيء واحد واحد إيجابي. غالبا ما يحدث هذا عندما يتم حل المواد في الماء (الكحول والأمونيا، وهلم جرا). وبفضل هذا الاتصال، جزيئات من البروتينات، والأحماض النووية، والكربوهيدرات المعقدة، وهلم جرا يمكن أن توجد.
- الترابط الأيوني. وهي تتشكل بسبب قوى الجذب الكهربائي من أيونات المعادن مشحونة بشكل مختلف واللافلزات. وكلما كان الفرق أقوى في هذا المؤشر، كلما زاد وضوحا هو الطابع الأيوني للتفاعل. أمثلة على المركبات: الأملاح الثنائية، المركبات المعقدة - القواعد، الأملاح.
- وسينظر في السندات المعدنية، وآلية تشكيل منها، وكذلك خصائص، أبعد من ذلك. وهي تتكون في المعادن وسبائكها بأنواعها المختلفة.
هناك شيء من هذا القبيل وحدة الوحدة الكيميائيةالاتصالات. يقول فقط أنه من المستحيل النظر في كل رابطة الكيميائية كمرجع. وهي كلها وحدات مشروط. بعد كل شيء، أساس كل التفاعلات هو مبدأ واحد - التفاعل الإلكترون ساكنة. ولذلك، فإن الرابطة الأيونية والمعدنية التساهمية والروابط الهيدروجينية لها طبيعة كيميائية واحدة وهي حالات حدودية فقط لبعضها البعض.
المعادن وخصائصها الفيزيائية
المعادن هي في الغالبية العظمى منجميع العناصر الكيميائية. ويرجع ذلك إلى خصائصها الخاصة. تم الحصول على جزء كبير منها من قبل الإنسان من ردود الفعل النووية في المختبر، فهي مشعة مع نصف عمر قصير.
ومع ذلك، فإن معظمها عناصر طبيعية،التي تشكل الصخور والخامات كلها، هي جزء من المركبات الأكثر أهمية. وكان من منهم أن الناس تعلموا أن يلقي السبائك وجعل الكثير من المنتجات الجميلة والمهمة. هذه هي مثل النحاس والحديد والألومنيوم والفضة والذهب والكروم والمنغنيز والنيكل والزنك والرصاص وغيرها الكثير.
وبالنسبة لجميع المعادن، يمكن تمييز الخصائص الفيزيائية العامة، وهو ما يفسر مخطط تشكيل السندات المعدنية. ما هي هذه الخصائص؟
- كوفكوست واللدونة. ومن المعروف أن العديد من المعادن يمكن أن توالت حتى إلى حالة من احباط (الذهب والألومنيوم). من الآخرين، يتم الحصول على الأسلاك، صفائح معدنية مرنة، والمنتجات قادرة على تشويه تحت تأثير البدني، ولكن على الفور استرداد شكل بعد وقفه. ومن هذه الصفات من المعادن التي تسمى قابلية والمرونة. والسبب في هذه الميزة هو النوع المعدني للاتصال. الأيونات والإلكترونات في الشريحة الكريستال بالنسبة لبعضها البعض دون كسر، والذي يسمح الحفاظ على سلامة الهيكل بأكمله.
- لامع تألق. وهذا يفسر أيضا السندات المعدنية، وآلية التعليم، وخصائصه وميزاته. وهكذا، ليست كل الجسيمات قادرة على امتصاص أو تعكس موجات الضوء من طول متساو. الذرات من معظم المعادن تعكس أشعة الموجة القصيرة واكتساب تقريبا نفس اللون الفضة والأبيض، هوى مزرق شاحب. الاستثناءات هي النحاس والذهب، واللون هو الأحمر المحمر والأصفر، على التوالي. فهي قادرة على تعكس أطول إشعاع الطول الموجي.
- التوصيل الحراري والكهربائي. وتفسر هذه الخصائص أيضا من خلال بنية شعرية الكريستال وحقيقة أنه في تشكيله يتم تحقيق نوع معدني من السندات. بسبب "الغاز الإلكتروني" تتحرك داخل الكريستال، يتم توزيع التيار الكهربائي والحرارة على الفور وبشكل متساو بين جميع الذرات والأيونات ويتم من خلال المعدن.
- الحالة الصلبة في ظل الظروف العادية. وهنا الاستثناء الوحيد هو الزئبق. جميع المعادن الأخرى هي بالضرورة قوية، والمركبات الصلبة، وكذلك سبائكها. هذا هو أيضا نتيجة لوجود السندات المعدنية في المعادن. آلية تشكيل هذا النوع من الجسيمات ملزمة تماما يؤكد خصائص.
هذه هي الخصائص الفيزيائية الأساسية لالمعادن، الذي يفسر ويحدد على وجه التحديد مخطط لتشكيل السندات المعدنية. مثل هذه الطريقة من الانضمام الذرات لعناصر معدنية وسبائكها هو الفعلي. وهذا هو بالنسبة لهم في حالة الصلبة والسائلة.

نوع المعدن من السندات الكيميائية
ما هي خصوصياتها؟ الشيء هو أن مثل هذا الاتصال يتم تشكيل ليس على حساب الأيونات المشحونة بشكل مختلف وجذبها كهرباء وليس على حساب الفرق في إليكترونيغاتيفيتي وجود أزواج الإلكترون الحرة. وهذا هو، الرابطة الأيونية، المعدنية، التساهمية لها طبيعة مختلفة إلى حد ما وسمات مميزة من الجسيمات التي تكون ملزمة.
وتتميز جميع المعادن بخصائص مثل:
- عدد قليل من الإلكترونات على مستوى الطاقة الخارجية (باستثناء بعض الاستثناءات، التي قد تكون 6.7 و 8)؛
- نصف قطر ذري كبير؛
- انخفاض طاقة التأين.
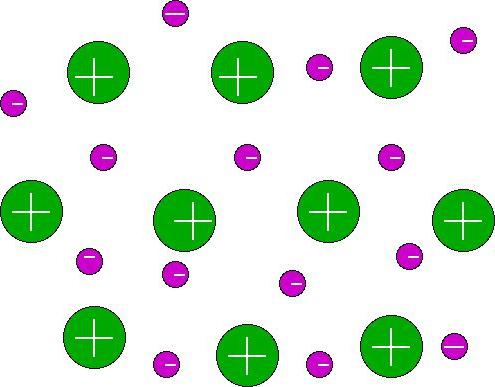
كل هذا يساهم في سهولة فصل الخارجيغير إلكترونات من النواة. هناك الكثير من المدارات الحرة في الذرة. فإن مخطط لتشكيل السندات المعدنية تظهر فقط تداخل العديد من الخلايا المدارية من ذرات مختلفة مع بعضها البعض، والتي نتيجة لذلك تشكل مساحة إنتراسيستالين مشتركة. يتم تغذية الإلكترونات من كل ذرة في ذلك، والتي تبدأ في التجول بحرية حول أجزاء مختلفة من شعرية. بشكل دوري، كل واحد منهم ينضم إلى أيون في عقدة الكريستال ويحولها إلى ذرة، ثم يفصل مرة أخرى، وتشكيل أيون.
وهكذا، فإن السندات المعدنية هي السنداتبين الذرات والأيونات والإلكترونات الحرة في الكريستال المعدني العام. وتسمى السحابة الإلكترونية التي تتحرك بحرية داخل هيكل "غاز الإلكترون". أنها تفسر معظم الخصائص الفيزيائية للمعادن وسبائكها.
كيف بالتحديد يفعل المعدن نفسهالرابطة الكيميائية؟ ويمكن إعطاء أمثلة مختلفة. دعونا نحاول أن ننظر إلى قطعة من الليثيوم. حتى لو كنت أعتبر حجم البازلاء، وسوف يكون هناك الآلاف من الذرات. دعونا نتصور أن كل من هذه الآلاف من الذرات يعطي تكافؤ الإلكترون واحد في الفضاء البلورية المشتركة. وفي الوقت نفسه، ومعرفة الهيكل الإلكتروني لهذا العنصر، يمكنك ان ترى عدد من المدارات فارغة. في الليثيوم، سيكون هناك 3 (ف المدارات من مستوى الطاقة الثاني). ثلاثة من كل ذرة من عشرات الآلاف - وهذا هو الفضاء المشترك داخل البلورة، التي "غاز الإلكترون" يتحرك بحرية.

مادة مع السندات المعدنية دائما قوية. بعد كل شيء، فإن غاز الإلكترون لا يسمح بلورة الكريستال، ولكن فقط تشريد الطبقات ثم يستعيدها. فإنه يضيء، لديه كثافة معينة (في معظم الأحيان عالية)، فوسيبيليتي، ليونة واللدونة.
أين آخر هو المعدن المستعبدين؟ أمثلة على المواد:
- المعادن في شكل هياكل بسيطة.
- جميع السبائك المعدنية مع بعضها البعض؛
- جميع المعادن وسبائكها في الحالة السائلة والصلبة.
أمثلة محددة يمكن أن تعطى ببساطة مبلغ لا يصدق، لأن المعادن في النظام الدوري هي أكثر من 80!
السندات المعدنية: آلية التعليم
إذا اعتبرنا ذلك بشكل عام، الأساسيةلحظات سبق ذكرها أعلاه. وجود المدارات الذرية الحرة والإلكترونات، والتي يتم فصلها بسهولة من النواة بسبب انخفاض طاقة التأين، هي الشروط الرئيسية لتشكيل هذا النوع من الاتصال. وهكذا، اتضح أنه يتحقق بين الجسيمات التالية:
- الذرات في المواقع شعرية.
- الإلكترونات الحرة، والتي كانت المعادن التكافؤ؛
- أيونات في مواقع الكريستال شعرية.
ونتيجة لذلك - اتصال معدني. يتم التعبير عن آلية التعليم بشكل عام من خلال الإدخال التالي: أنا0 - ه- ↔ ميn +. من الرسم البياني فمن الواضح التي الجسيمات موجودة في وضوح الشمس من المعدن.
بلورات نفسها يمكن أن يكون الأشكال المختلفة. ذلك يعتمد على المادة المحددة التي نتعامل معها.
أنواع البلورات المعدنية
هذا الهيكل من المعدن أو سبيكةتتميز التعبئة الكثيفة جدا من الجسيمات. يتم توفيره من قبل الأيونات في مواقع الكريستال. قد يكون صريف نفسها من الأشكال الهندسية المختلفة في الفضاء.
- والشعر المكعب التي تركز على الجسم هو المعادن القلوية.
- الهيكل المضغوط سداسية هو كل الأرض القلوية ، باستثناء الباريوم.
- مكعب ذو محور وجهي - الألمنيوم ، النحاس ، الزنك ، العديد من المعادن الانتقالية.
- الهيكل المعين هو في الزئبق.
- رباعي الأرجل هو الإنديوم.
أثقل المعدن وأقل هو فيهنظام دوري ، وأكثر تعقيدا التعبئة والتغليف والتنظيم المكاني للبلورة. في هذه الحالة ، تعتبر الرابطة الكيميائية المعدنية ، التي يمكن إعطاء أمثلة لكل معدن قائم ، أهمية حاسمة لبناء البلورة. تمتلك السبائك منظمات متنوعة للغاية في الفضاء ، وبعضها لم يتم استكشافه بالكامل بعد.

خصائص الاتصال: غير الاتجاهية
السندات التساهمية والمعدنية لديها واحدةوضوحا ميزة مميزة جدا. على عكس الأول، السندات المعدنية ليست الاتجاهية. ماذا يعني هذا؟ وهذا يعني أن سحابة الإلكترون داخل البلورة تتحرك بحرية تامة داخل حدودها في اتجاهات مختلفة، كل من الإلكترونات قادرة على إرفاق أي أيون على الإطلاق في العقد من الهيكل. أي أن التفاعل يحدث في اتجاهات مختلفة. وبالتالي يقولون أن السندات المعدنية غير اتجاهي.
آلية الرابطة التساهمية يعني ضمناتشكيل أزواج إلكترونية مشتركة ، أي سحب من الذرات المتداخلة. ويحدث ذلك بدقة وفقا لخط معين يربط مراكزهم. لذلك ، نحن نتحدث عن اتجاه مثل هذا الاتصال.
saturability
وتعكس هذه الخاصية قدرة الذراتإلى التفاعل المحدود أو غير المقيد مع الآخرين. وهكذا، فإن السندات التساهمية والمعدنية في هذا المؤشر هي مرة أخرى المعارضين.
الأول هو تشبع. ذرات تشارك في تشكيلها هي عدد محدد من إلكترونات التكافؤ الخارجية بشكل مباشر في تشكيل المجمع. أكثر من هو، وقال انه لن يكون الإلكترونات. ولذلك، فإن عدد السندات شكلت محدودة من التكافؤ. وبالتالي تشبع السندات. نظرا لهذه الخاصية من الغالبية العظمى من المركبات لديها التركيب الكيميائي المستمر.
الروابط المعدنية والهيدروجينية، على العكس من ذلك،غير مرضية. ويوضح ذلك وجود العديد من الإلكترونات الحرة والمدارات داخل البلورة. أيضا ، لعبت دور الأيونات في المواقع شعرية ، كل منها يمكن أن تصبح ذرة ومرة أخرى أيون في أي وقت.

سمة أخرى من السندات المعدنية -تحريك السحابة الإلكترونية الداخلية. ويتجلى ذلك في قدرة عدد قليل من الإلكترونات الشائعة على ربط العديد من نويات الذرة الذرية. أي أن الكثافة ، كما هي ، يتم تفكيكها وتوزيعها بالتساوي بين جميع وصلات البلورة.
أمثلة على تكوين السندات في المعادن
دعونا ننظر في العديد من الخيارات المحددة التي توضح كيفية تشكيل السندات المعدنية. أمثلة على المواد هي كما يلي:
- الزنك؛
- الألومنيوم.
- البوتاسيوم.
- الكروم.
تشكيل رابطة معدنية بين ذرات الزنك: Zn0 - 2e- ↔ زنك2+. تحتوي ذرة الزنك على أربعة مستويات للطاقة. المدارات الحرة ، استنادا إلى البنية الإلكترونية ، لديه 15-3 في المدارات p ، 5 في 4 د و 7 في 4f. الهيكل الإلكتروني هو على النحو التالي: 1S22S22P63S23P64S23D104P04D04F0 ، مجموع في ذرة من 30 إلكترون. وهذا يعني أن جسيمتين سالبتين حرتيتي التكافؤ قادرة على التحرك داخل 15 مدارًا واسعًا وغير مشغول. وهكذا في كل ذرة. ونتيجة لذلك - مساحة مشتركة ضخمة تتكون من مدارات فارغة ، وعدد صغير من الإلكترونات التي تربط بين البنية بأكملها معا.
الرابطة المعدنية بين ذرات الألمنيوم: AL0 - ه- ↔ AL3+ . توجد ثلاثة عشر إلكترونًا من ذرة ألمونيوم على ثلاثة مستويات للطاقة ، والتي من الواضح أن لديها ما يكفي لملءها. الهيكل الإلكتروني: 1S22S22P63S23P13D0. المدارات الحرة - 7 قطع. من الواضح أن سحابة الإلكترون ستكون صغيرة بالمقارنة مع الفضاء الحر الداخلي العام في البلورة.

رابطة معدنية من الكروم. هذا العنصر مميز في هيكله الإلكتروني. بعد كل شيء ، لتحقيق الاستقرار في النظام ، هناك فشل في الإلكترون من 4 إلى مدارات ثلاثية الأبعاد: 1S22S22P63S23P64S13D54P04D04F0. ما مجموعه 24 إلكترون ، منها التكافؤتبين ستة. هم الذين يذهبون إلى الفضاء الإلكترونية المشتركة لتشكيل الروابط الكيميائية. المدارات الحرة 15 ، التي لا تزال أكثر بكثير من المطلوب للتعبئة. لذلك ، يعتبر الكروم أيضًا مثالًا نموذجيًا للمعادن ذات الرابطة المناسبة في الجزيء.
واحدة من المعادن الأكثر نشاطا رد فعلحتى مع الماء العادي مع النار ، هو البوتاسيوم. ما يفسر هذه الخصائص؟ مرة أخرى ، بطرق عديدة - نوع معدني من الاتصال. لا يوجد سوى 19 إلكترونًا في هذا العنصر ، ولكنها تقع في 4 مستويات طاقة. وهذا هو ، على 30 المدارات من sublevels مختلفة. الهيكل الإلكتروني: 1S22S22P63S23P64S13D04P04D04F0. اثنين فقط من إلكترونات التكافؤ ، مع منخفضة جداطاقة التأين. استراحة مجانية والذهاب إلى الفضاء الإلكتروني المشترك. Orbital لتحريك ذرة واحدة 22 قطعة ، أي مساحة حرة كبيرة جدًا لـ "الغاز الإلكتروني".
التشابه والاختلاف مع أنواع الاتصالات الأخرى
بشكل عام ، وقد سبق مناقشة هذه المسألة أعلاه. يمكن للمرء فقط أن يعمم ويرسم خاتمة. السمات المميزة الرئيسية لجميع أنواع الاتصالات الأخرى لخصائص البلورات المعدنية هي:
- عدة أنواع من الجسيمات المشاركة في عملية الارتباط (الذرات ، الأيونات أو أيونات الذرة ، الإلكترونات) ؛
- البنية الهندسية المكانية المختلفة للبلورات.
مع معدن الهيدروجين والايوني السنداتيوحد عدم التشبع وعدم الاتجاه. مع التساهمية القطبية - جذب كهربائي قوي بين الجسيمات. منفصلة مع الأيونية - نوع الجسيمات في العقد من شعرية الكريستال (الأيونات). مع التساهمية nonpolar - ذرات في العقد من البلورة.
أنواع السندات في المعادن من الدول المختلفة
كما أشرنا أعلاه ، يتم تشكيل الرابطة الكيميائية المعدنية ، والأمثلة الواردة في المقالة ، في حالتين إجماليتين من المعادن وسبائكها: الصلبة والسائلة.
السؤال الذي يطرح نفسه: ما هو نوع الرابطة في الأبخرة المعدنية؟ الجواب: التساهمية القطبية وغير القطبية. كما هو الحال في جميع المركبات في شكل غاز. أي عندما يتم تسخين المعدن لفترة طويلة ونقله من حالة صلبة إلى رابطة سائلة ، يتم الحفاظ على البنية البلورية. ومع ذلك ، عندما يتعلق الأمر بنقل سائل إلى حالة بخار ، يتم تدمير البلورة ويتم تحويل السندات المعدنية إلى رابطة تساهمية.
</ p>